Ley de conservación de la masa o materia
La ley de conservación de la energía establece que la energía total de un sistema aislado nunca cambia, y eso se puede expresar de varias maneras. Uno de estos es KE (energía cinética) + PE (energía potencial) + energía interna (IE) = una constante. Esta ley se desprende de la primera ley de la termodinámica y asegura que la energía.
Arriba 104+ Foto Ejemplos De Ley De La Conservacion De La Masa Alta Definición Completa, 2k, 4k

La ley de la conservación de la masa es uno de los tres postulados por los cuales se rige los cambios químicos. Esta ley fue enunciada por el químico francés Antoine Lavoisier (1743-1793) en la segunda mitad del siglo XVIII, y por tal razón es también conocida como Ley de Lavoisier. Lavoisier demostró experimentalmente que la masa total.
Ley Conservación Masa Diagrama Infográfico Que Muestra Experimento Laboratorio Entre Stock

El principio de conservación de la masa se basa en la idea de que la materia no puede ser creada ni destruida, solo transformada. Según la teoría atómica, toda materia está compuesta por átomos, los cuales son indivisibles y no se pueden crear ni destruir durante una reacción química o física. Esto implica que la masa total de los.
Ley de la conservación de la masa Química, Reacciones quimicas, Ecuaciones

Una de ellas se llama la ley de conservación de la masa, que establece que durante una reacción química, la masa total de los productos debe ser igual a la masa total de los reactivos. En otras palabras, la masa no puede crearse ni destruirse durante una reacción química, sino que siempre se conserva. Como ejemplo, considere la reacción.
⚡Ley de la CONSERVACIÓN DE LA MASA 🎯 en reacciones químicas YouTube

La Ley de la Conservación de la Masa establece que la masa total de una sustancia no cambia durante una reacción química. La cantidad de masa al inicio de la reacción debe ser igual a la cantidad de masa al final. En términos matemáticos, esto se puede expresar de la siguiente manera: Masa inicial = Masa final.
Ley de conservación de la masa

Ecuaciones. La ley de conservación de la masa se observa en una ecuación química balanceada , que es una ecuación química que muestra que toda la masa se conserva durante la reacción. En una ecuación química balanceada, el número y los tipos de átomos en cada lado de la ecuación deben ser iguales. Las ecuaciones químicas que no.
Ley de conservación de la masa Imágenes vectoriales de stock Alamy
RM2AN1AM6 - La filosofía de la biología . la temperatura es más baja, y su camino libre medio tiende a becomegreater. El volumen de la masa de acertain de gas, Es decir, el volumen ocupado por el aquero muy grande numberof moléculas, es mayor que la temperatura, siempre que el sobre isone capaz de jdeldingl Ifwe reducir la capacidad del sobre en el que está contenido el gas, la.
Ley de conservación de la masa

La ley de conservación de la masa se refiere a la capacidad de una sustancia para mantener su masa, incluso si se transforma de un estado a otro. En otras palabras, la masa de un objeto no puede ser creada ni destruida, solo transformada. Esta ley es un principio fundamental de la física y se aplica tanto a la materia como a la energía.
Ley de la CONSERVACIÓN de la MASA (en reacciones químicas) YouTube

La ley de conservación de la masa, también conocida como la ley de Lavoisier o la ley de conservación de la materia, es una de las leyes fundamentales de la química. Esta ley establece que en cualquier reacción química, la masa total de los reactivos es igual a la masa total de los productos. En otras palabras, la materia no puede ser.
método cientifico Ley de la conservacion de la masa
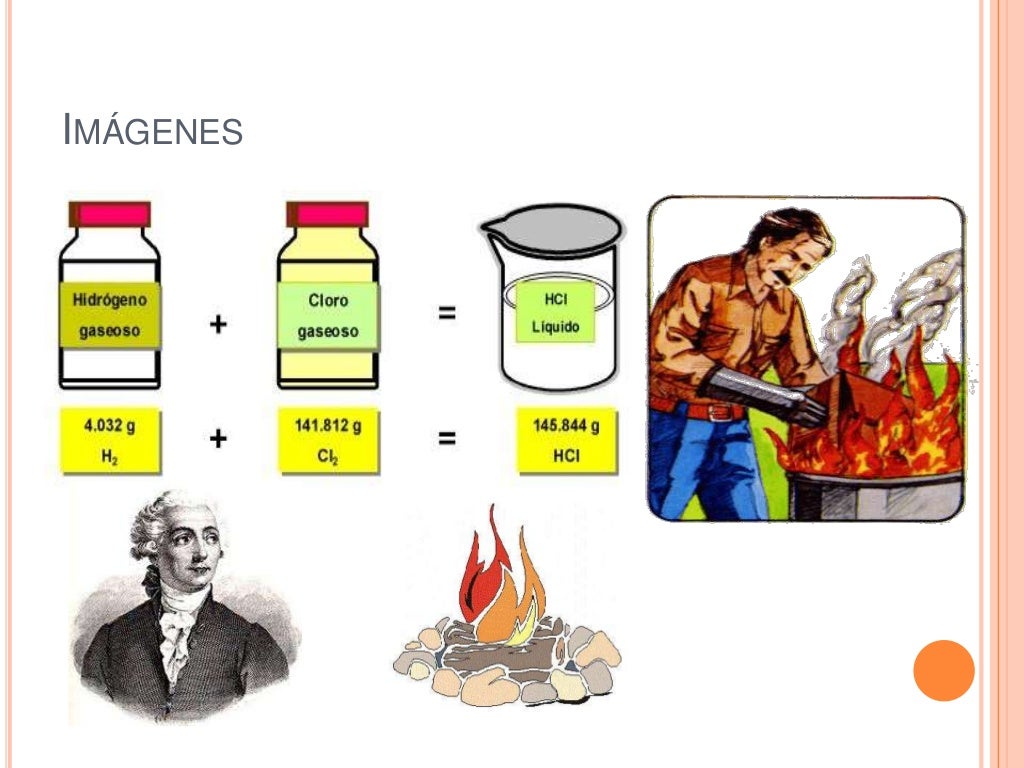
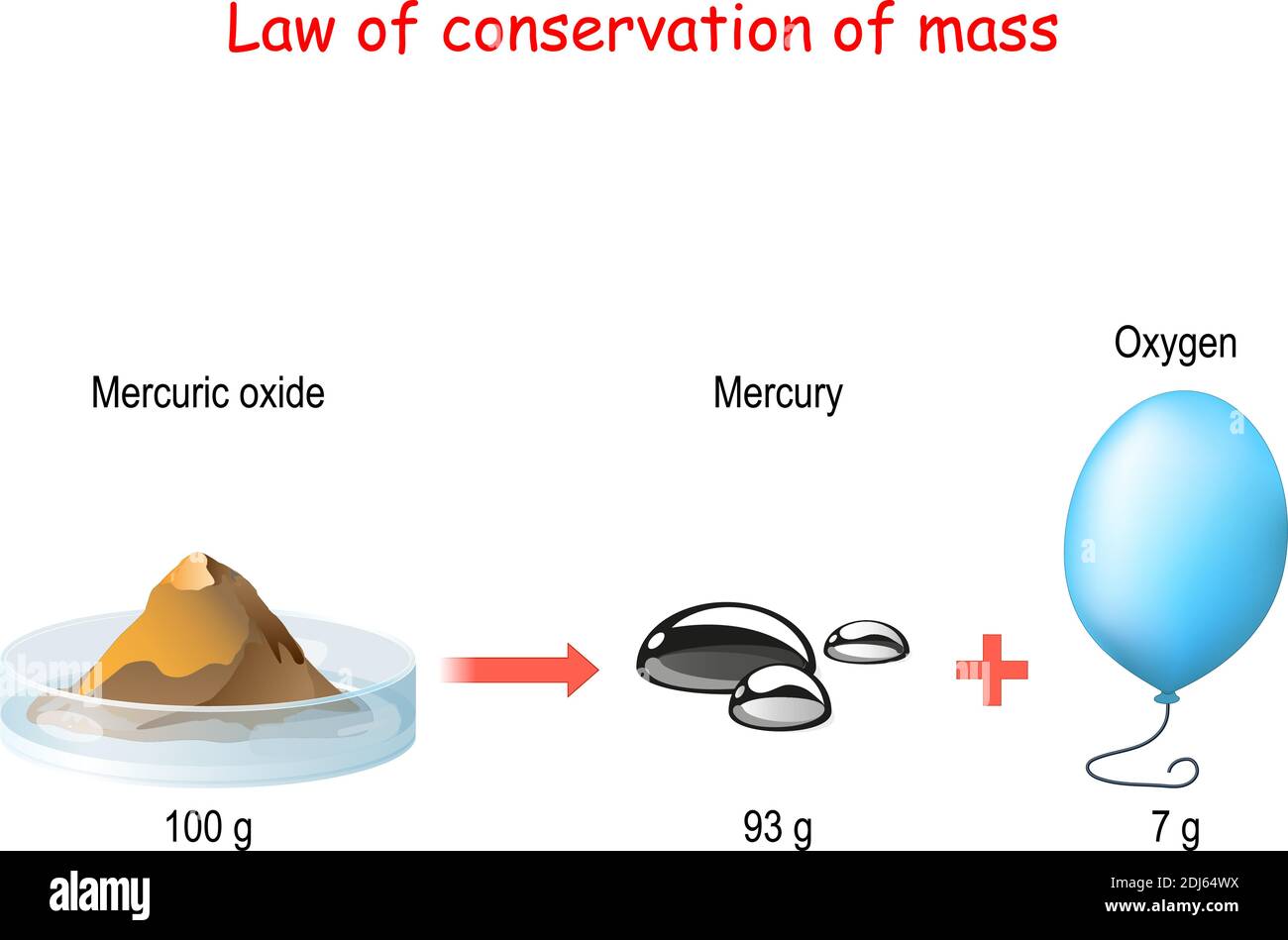
Aplicando la ley, tenemos: masa de cobre + masa de oxígeno = masa de óxido. masa de oxígeno = masa de óxido - masa de cobre. masa de oxígeno = 35 g - 5 g. masa oxígeno = 30 g. Convierta a TP Laboratorio Químico en su fuente de noticias. En 1774, Antoine Lavoisier (1743-1794) realizó un experimento calentando un recipiente de vidrio.
PRÁCTICA 1 LEY DE LA CONSERVACIÓN DE LA MATERIA.docx Importar Masa

Lavoisier llevó a cabo un experimento en el que se midió la masa de un metal y el aire dentro de un recipiente cerrado antes y después de una combustión. A través de la observación de la ganancia de masa del metal y la pérdida de masa del aire, Lavoisier demostró que la masa no se crea ni se destruye, sino que se conserva en un sistema.
Ley de conservación de la masa o materia
De acuerdo a la ley de la conservación de la materia, la masa de AB2 debe ser igual a la sumatoria de las masas de A y B2, respectivamente. Entonces, si 37 g de A reaccionan con 13 g de B2, el producto AB2 debe pesar 50 g. Por lo tanto, en una ecuación química, la masa de los reactivos (A y B2) debe ser siempre igual a la masa de los.
Arriba 104+ Foto Ejemplos De Ley De La Conservacion De La Masa Alta Definición Completa, 2k, 4k

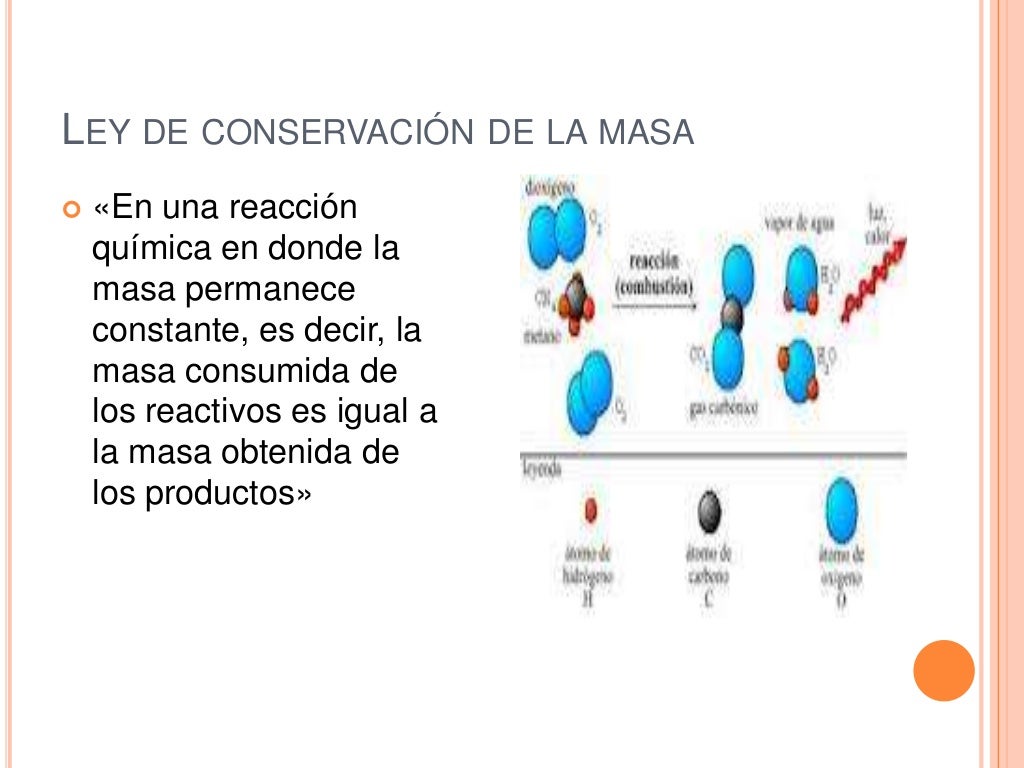
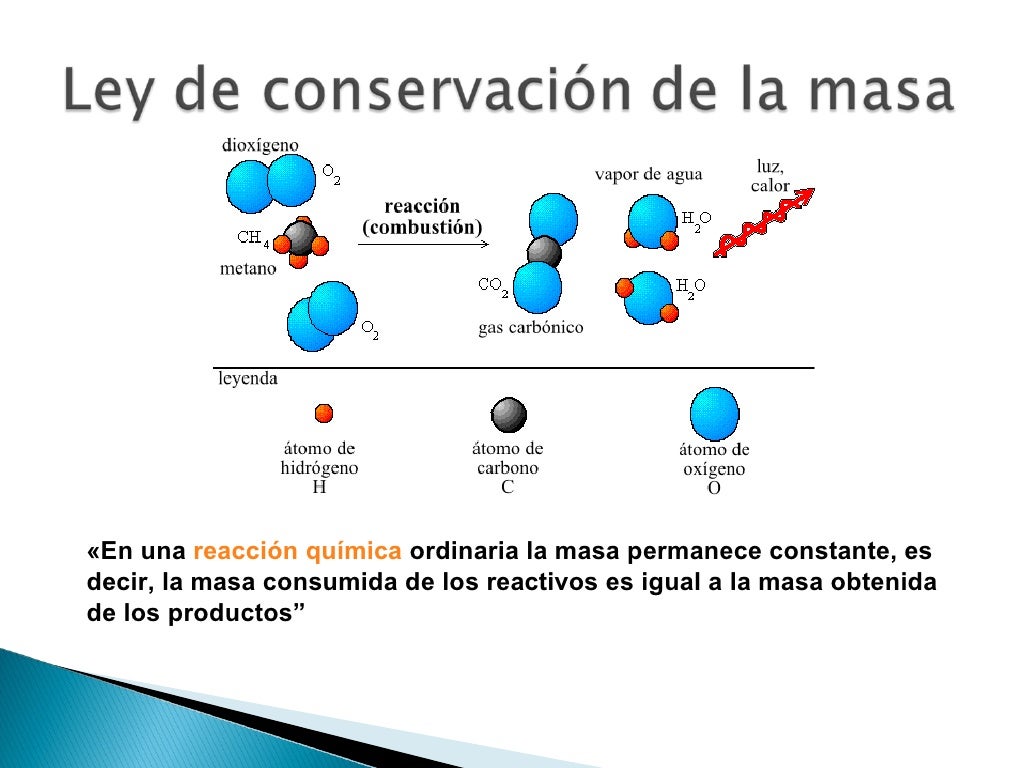
Ejemplo de la Ley de conservación de la materia. Un perfecto ejemplo de esta ley lo constituye la combustión de hidrocarburos, en la que puede verse al combustible arder y "desaparecer", cuando en realidad se habrá transformado en gases invisibles y agua. Por ejemplo, al quemar metano (CH 4) tendremos la siguiente reacción, cuyos.
Ley de conservación de la masa
La ley de la conservación de la masa es uno de los fundamentos centrales de la química y la física modernas. Esta ley establece que la masa total de un sistema aislado no cambia durante sus transformaciones, como la reacción química o un proceso físico.
Ley de conservación de la masa

En física, una ley de conservación es una afirmación de que la cantidad total de una determinada cantidad física siempre permanece igual. Este capítulo trata sobre la conservación de la masa. El sistema métrico está diseñado alrededor de una unidad de distancia, el metro, una unidad de masa, el kilogramo y una unidad de tiempo, la segunda.
LEY DE LA CONSERVACIÓN DE LA MATERIA. (BALANCEO DE ECUACIONES QUÍMICAS) YouTube

Ejemplo de la Ley de conservación de la materia. Un perfecto ejemplo de esta ley lo constituye la combustión de hidrocarburos, en la que puede verse al combustible arder y "desaparecer", cuando en realidad se habrá transformado en gases invisibles y agua. Por ejemplo, al quemar metano (CH 4) tendremos la siguiente reacción, cuyos.
.